
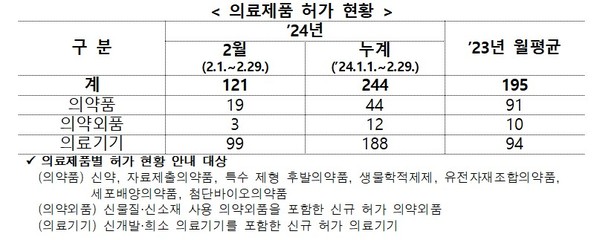
식품의약품안전처가 지난 2월에 허가한 의료제품은 총 121개 품목으로 지난해 같은 기간보다 감소한 것으로 나타났다.
식약처는 의료제품 허가심사에 대한 투명성과 신뢰성을 강화하기 위해 ’2024년 2월 의료제품 허가 현황을 3월 12일 공개했다.
지난 2월 식약처 허가 심사를 통과한 의료제품은 총 121개 품목으로, 이는 지난해 월평균 허가 건수 195개 품목 대비 62% 수준에 그쳤다.
세부적으로 의약품과 의약외품의 허가 건수는 평균보다 적은 달이었고, 의료기기 허가 건수는 큰 차이가 없었다.
주요 허가 품목을 보면 활동성 궤양성 대장염 치료제인 ‘옴보주20mg/ml(미리키주맙)’, ‘옴보프리필드펜주100mg/ml(미리키주맙)’, ‘옴보프리필드시린지주100mg/ml(미리키주맙)’(’24.2.7.)가 신약으로 허가되어 대장염 치료제 선택의 영역이 확대됐다.
아울러 근시 굴절이상 시력보정에 사용되는 의료기기인 ‘매일착용 소프트 콘택트렌즈(모델명: ACUVUE® Abiliti™ 1-Day Soft Therapeutic Lenses for Myopia Management)’가 7~12세 사용 가능으로 허가돼 기존에 허가된 제품의 사용 연령이 8~12세인 것과 비교했을 때 1살 어려졌다.
식약처는 앞으로도 의료제품 허가 현황을 정례적으로 제공해 의약품의 허가 심사의 투명성을 높이고, 안전하고 유효한 제품을 신속히 허가해 환자 치료 기회를 지속적으로 확대해 나갈 계획이다.
의료제품별 상세한 허가사항은 전자민원시스템에서 확인할 수 있다.

