비만 및 대사질환과 관련된 염증 반응
TLR4 신호 전달 경로에 대한 이해
비만은 심혈관계 질환, 제2형 당뇨병, 비알코올성 지방간, 특정 유형의 암에 이르기까지 각종 체내 염증성 질환을 일으키는 직접적인 원인으로 꼽힙니다.
일반적인 염증은 감염, 상처 치유를 위한 반응이지만, 비만에 의한 염증 반응은 이들과는 조금 다른 기전으로 TLR4 (toll-like receptor 4) 경로가 주된 경로 중의 하나입니다.
그리고 오메가3 불포화지방산이 LPS(lipopolysaccharides)나 포화지방산에 의한 TLR4경로의 발현을 조절하는 기능을 합니다.
오메가3의 염증관련 신호 전달 과정에 대한 최신 내용을 전하기 위해서 우선 이들 신호 전달 과정에 대한 내용부터 설명합니다.
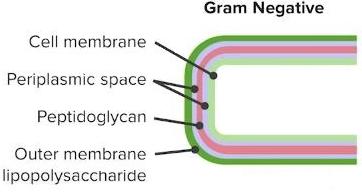
LPS(lipopolysaccharides)는 그람음성균의 세포벽에서 발견되며, 대식세포, 호중구, TNF-α, IL-1의 염증 반응과 관련됩니다.
염증과 인슐린 저항성, 당뇨의 관계는 잘 알려져 있는데 백색지방의 마크로파지, 그중에서도 M1 macrophage가 TNF-α, IL-1β, IL-6의 분비에 관여합니다.
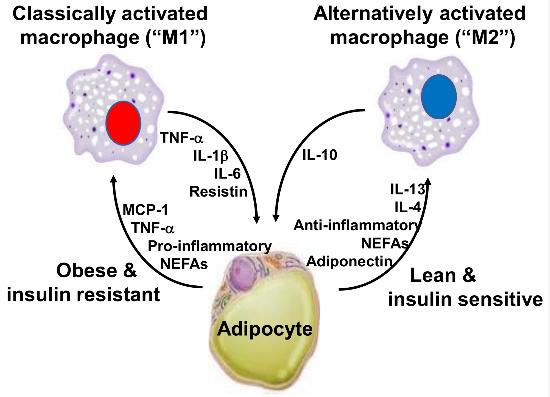
특히 M1의 이러한 반응은 비만하고 인슐린 저항성이 있는 백색지방에서는 40%를 차지하는 반면 야위고 인슐린 민감성이 있는 백색지방에서는 18%만 유도되는 것으로 나타났습니다.
그림에서 MCP는 monocyte chemotactic protein이고 NEFAs는 non-esterified fatty acids입니다.
MCP-1의 경우 그 수용체가 말초혈관과 비만세포에서만 발현되며 MCP-1은 피하지방보다 내장지방에서 더 많이 활성화됩니다.
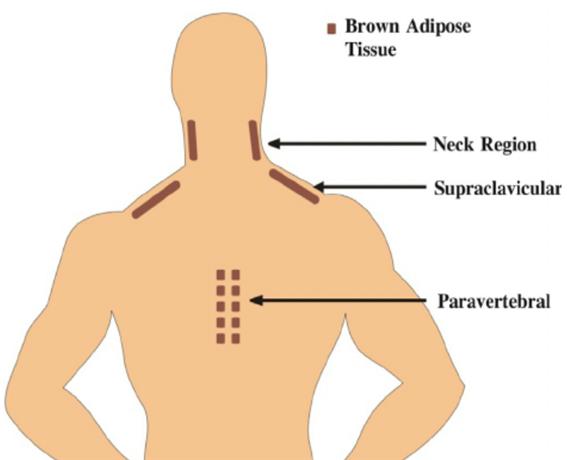
<갈색지방 BAT의 역할>
갈색지방 BAT은 백색지방의 대척점에 있는 지방세포로서 태아, 신생아에게 활성화되고 성인이 되면 경추 쇄골, 척추 등에만 남아있게 되며 체내 열 발산에 UCP-1(uncoupling protein 1)과 함께 관여합니다.
BAT이 제거된 마우스는 인슐린 저항성, 중성지질의 증가가 있었으며 BAT이 줄어드는 것은 확실히 BMI, 내장지방 및 지방량의 증가와 관련되며 BAT 및 UCP-1의 부족은 비만과 관련이 됩니다. 또 내장지방의 증가에 의한 TNF-α의 증가가 다시 BAT의 감소를 초래합니다.
비만한 사람은 증가하는 염증물질에 의해 골격근의 인슐린 저항성을 갖는데 이는 IRS(insulin receptor substrate)-1의 tyrosine잔기의 인산화 부족과 IKK(inhibitor of kappa B kinase)와 JNK(c-jun N-terminal kinase)-1에 의한 세린 잔기의 인산화 그리고 PI3K(phosphatidylinositol-4,5-bisphosphate 3-kinase)활성의 감소가 원인입니다.
또, 비만환자에게서 많이 나오는 염증성 사이토카인 IL-6는 SOCS3(cytokine signaling suppressor protein 3)를 유도하는데 이 역시 타이로신 잔기의 인산화를 억제하여 인슐린 저항성을 유발합니다.
IKK(inhibitor of kappa B kinase)-β, JNK(c-jun N-terminal kinase)-1는 NF-κB(nuclear factor kappa B), AP-1을 자극하여 인슐린 저항성 및 동맥경화와 관련된 TNF-α, COX-2 같은 염증성 물질을 생성하게 합니다.
염증 및 비만과 장내 미생물군체도 관련이 있습니다. 호중구(neutrophils)와 대식세포 (macrophages)는 PAMPs(pathogen-associated molecular patterns)라는 병원체 관련 분자 패턴이 있는 병원균에 대해 면역반응을 일으키며 PAMPs 중의 하나가 LPS입니다. 이러한 PAMPs를 감지한 선천면역계의 패턴인식수용체가 TNF-α, IL-1β 같은 염증성 사이토카인을 분비하게 유발하고 항미생물 작용의 NO, ROS를 분비하게 하며 CD80(cluster of differentiation 80), CD86(cluster of differentiation 86) 및 MHC(major histocompatibility complex) class II를 통해 CD4+ T림프구에 항원을 제시하도록 하여 후천면역반응을 일으키는 작은 항원 펩타이드들을 생성케 합니다.
선천면역계는 TLR(toll-like receptor)를 통하여 PAMPs를 인식하게 되는데 사람에게는 TLR4가 처음 보고되었으며 TLR4는 단핵구, 대식세포, 수지상세포, 지방세포, 근육세포 등에 분포하고 있습니다.
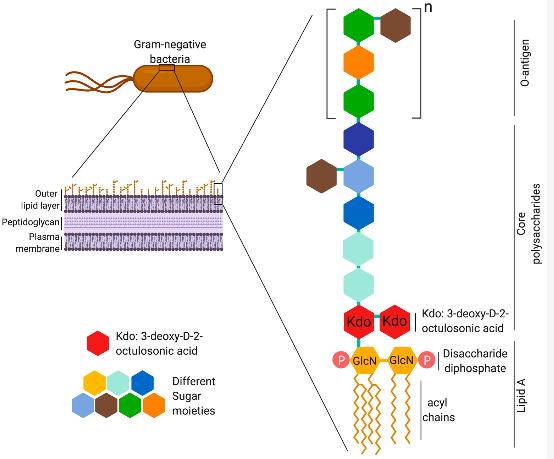
한편 LPS는 친수성 polysaccharide와 소수성 lipid A로 구성되어 있습니다.
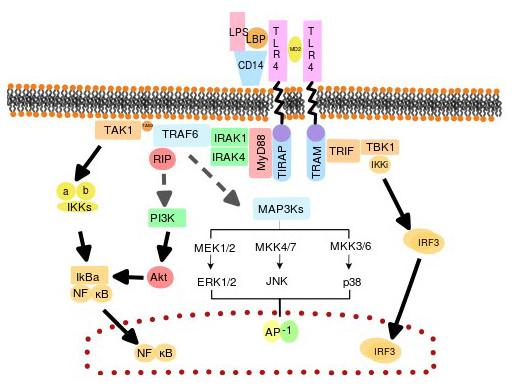
LPS는 처음에 혈액이나 세포외 공간에서 발견되는 LPS 결합 단백질(LBP)에 결합합니다. 이 단백질은 CD14 분자와 LPS의 결합을 촉진하며, 이 결합체는 내피성 분자를 제외한 대부분의 세포에서 발견되는 glycophosphatidylinositol group을 이용하여 지질층에 있게 됩니다.
CD14는 수용성 단백질로도 존재할 수 있으며, 이 경우 LPS를 세포 표면으로 유도할 수 있습니다. CD14 분자는 transmembrane 및 세포내 영역에서는 존재하지 않으므로 스스로 신호 전달 과정을 촉발할 수 없으나 LPS가 CD14에 결합되면 LBP가 분리되어 LPS-CD14 결합체가 TLR4와 연결됩니다. 이 수용체가 LPS를 인식하기 위해서는 TLR4의 세포외 복합체에 결합하는 세포외 부속 단백질(MD2)이 추가로 필요합니다.
한 줄 요약 :
LPS에 대한 TLR4관련 면역반응은 MD-2, CD14 복합체가 형성되어야 -> 신호전달에 의한 NF-κB의 활성이 이루어진다.
TLR4 이량체를 이룬 뒤에 과정은 MyD88관련 경로에 대한 이해가 필요합니다.
TLR은 세포내 부분과 세포외 부분으로 나뉘는데, 세포내 부분은 IL-1 수용체(IL-1R) family와 매우 유사하여 “TIR(Toll/interleukine-1 receptor)” 도메인이라 부르고, 세포외 부위에 leucine-rich 반복부위(LRRs)를 가지고 있습니다. TIR 도메인의 신호전달경로의 하위인자에서 TIR domain-containing adaptor인 MyD88(myeloid differentiation
marker 88)가 있는데, TLR 신호전달경로는 모든 TLRs에 대하여 흔하다고 알려진 MyD88-의존성 전달경로(MyD88-dependent pathway)와 TLR3-와 TLR4 신호전달경로로 알려진 MyD88-비의존성 전달경로(MyD88-independent pathway)가 있습니다.
MyD88-dependent pathway와 관련하여
MyD88은 개개의 TIR 도메인과의 상호작용을 통하여 세포질내 TIR부위에 결합합니다. TLR이 활성화되면, IRAK(IL-1 receptor associated kinase)-4, IRAK(IL-1 receptor associated kinase)-1과 TRAF(TNF receptor associated factor)6가 수용체로 모이게 되고 이는 death domain을 통하여 IRAK-1과 MyD88의 상호작용을 유도하게 됩니다. 그리고 IRAK-4는 IRAK-1을 인산화합니다. 인산화된 IRAK-1는 TRAF6와 함께 수용체에서 분리되고 TRAF6와 TAK1(transforming growth factor-β-activated kinase 1), TAB1(TGF-Beta Activated Kinase 1) 및 TAB2(TGF-Beta Activated Kinase 2)와 반응하게 됩니다. TRAF6/TAK1/TAB1복합체와 TAB2는 Ubc13( ubiquitin E2 conjugating enzyme)과 Uev1A(Ubiquitin-conjugating enzyme E2 variant 1A)와 함께 더욱 큰 복합체를 형성하게 되며, 이는 TAK1의 활성화를 유도합니다. 활성화된 TAK1(transforming growth factor-β-activated kinase 1)은 IKKα, IKKβ, NEMO/IKKγ로이루어진IKK 복합체(IκB kinase complex)를 인산화하고, JNK와 같은 MAPkinase(mitogen activated protein kinase)를 인산화하여 NF-κB와 AP-1이라는 전사인자를 각각 활성화시킵니다.
IκB(inhibitor of nuclear factor kappa-B kinase) 단백질들에는 IκBα, IκBβ, IκBε, Bcl-3 등이 있으며 IκB와 NF-κB는 각각의 친화성에 따라 결합체를 이룹니다.
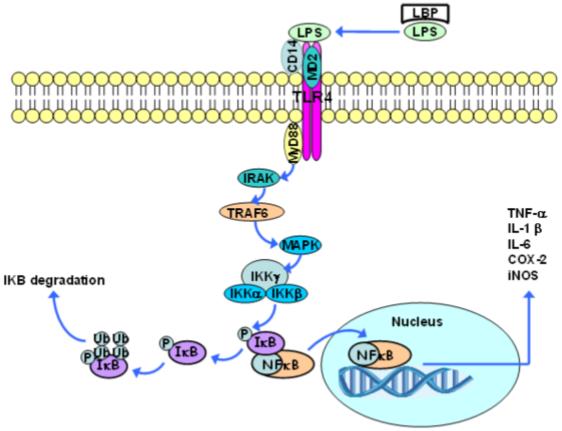
한편, 잠시 언급된 TRAF(TNF receptor associated factor)6는 MAPK를 통해 2개의 촉매 역할의 서브유닛(IKKα와 IKKβ)과 1개의 조절 역할의 서브유닛(IKKγ)으로 구성된 IκB kinase complex (IKK)를 활성화하고, IκB 인산화 유도 능력을 가지고 있습니다. 이러한 인산화 작용으로 IκB가 NF-κB 복합체로부터 분리되고 결과적으로 IkB가 분해됩니다. 이 과정을 통해 NF-κB 이량체가 핵으로 번역되어 TNF-α, IL-1β, IL-6, COX-2, INOS (inducible nitric oxide synthase) 등 κB-dependent 유전자인 염증성 사이토카인 유전자의 전사를 활성화할 수 있습니다. NF-κB도 IκB의 합성을 자극합니다. 따라서, 새로 합성된 IκB는 NF-κB에 결합하여 활동을 억제하는 피드백 메커니즘을 제공합니다.
※ 참고
https://www.researchgate.net/figure/Location-of-BAT-in-normal-healthy-human-BAT-locations-are-marked-with-brown-shade-and_fig1_264858319
https://www.researchgate.net/figure/Fig-2-The-glycosylphosphatidylinositol-GPI-anchor-of-the-variable-surface_fig2_41450432
https://www.mdpi.com/1422-0067/21/2/379/htm
https://www.cusabio.com/c-20921.html
https://www.researchgate.net/figure/Lipopolysaccharide-structure-LPS-contains-a-hydrophobic-lipid-A-domain-and-hydrophilic_fig2_13473930


