차 의과학대학교(총장 김동익) 생명과학과 도현아 학생(석사과정)과 백광현 교수팀은 단백질 분해조절 효소가 퇴행성 뇌질환을 유발하는 다양한 독성 단백질을 조절한다는 연구결과를 발표했다.
이번 연구는 난치병 분야로 알려진 알츠하이머병, 파킨슨병, 루게릭병, 헌팅턴병과 같은 퇴행성 뇌질환 치료에 새로운 가능성을 시사했다.
도현아 학생과 백광현 교수는 독성 단백질이 유비퀴틴화 과정 중 어떤 요인에 의해 분해·조절되는지 연구를 진행했다.
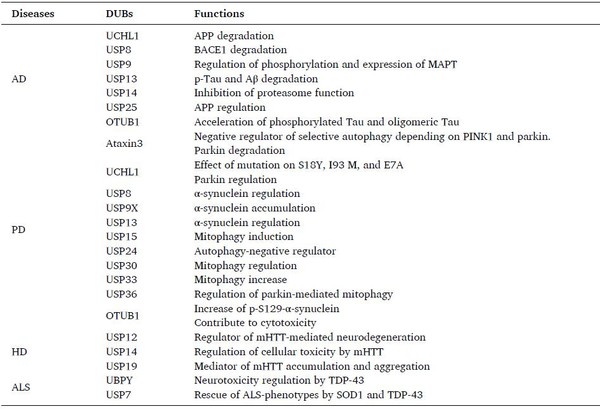
그 결과 퇴행성 뇌질환을 유발하는 다양한 독성 단백질(amyloid-β, Tau, α-synuclein, TDP-43, Htt 등)은 '단백질 분해조절 효소'에 의해 조절된다는 것이 밝혀졌다.
단백질 분해조절 효소는 우리 세포 내에 100여 개 존재하는데, 연구팀은 이중 18개(자료 참조)가 퇴행성 뇌질환을 유발하는 독성단백질을 분해·조절하는 것을 확인했다.
또한 6개의 단백질 분해조절 효소(UCHL, USP8, USP9X, USP13, OTUB1, USP14)가 한 개 여러 개의 독성 단백질을 분해·조절 하는 것을 확인했다.
논문을 게재한 도현아 학생은 "단백질 분해조절 효소는 퇴행성 뇌질환을 유발하는 독성 단백질을 효과적으로 조절할 수 있기 때문에 새로운 치료제의 배경이 될 수 있을 것으로 기대한다" 며 "현재 진행하고 있는 연구에 이어 정상군과 치매환자 샘플에서 유전자 발현 차이를 확인하기 위해 준비 중"이라고 밝혔다.
이번 연구는 한국연구재단의 대학중점연구소 지원사업의 일환으로 진행됐으며, 노화관련 국제 SCIE 학술지인 Ageing Research Reviews(IF, impact factor: 10.895)에 게재 됐다.

