
‘긴급사용 승인제도’는 감염병 대유행이 우려되어 긴급히 진단시약이 필요하나 국내에 허가제품이 없는 경우 또는 제조‧허가 등을 받고 사용되는 의료기기의 공급이 부족허가나 부족할 것으로 예측되는 경우 중앙행정기관이 요청한 진단시약을 식약처장이 승인하여 한시적으로 제조․판매․사용할 수 있게 하는 제도다.
식약처는 코로나19로 인해 질병관리본부가 코로나19 응급용 선별검사 진단시약의 긴급사용 신청한 13개 제품 중 3개 제품에 대한 긴급사용을 승인했다.
식품의약품안전처(처장 이의경)는 질병관리본부의 응급용 선별검사 목적 코로나19 진단시약 긴급사용 승인 요청에 대하여 적합한 3개 제품을 승인했다.
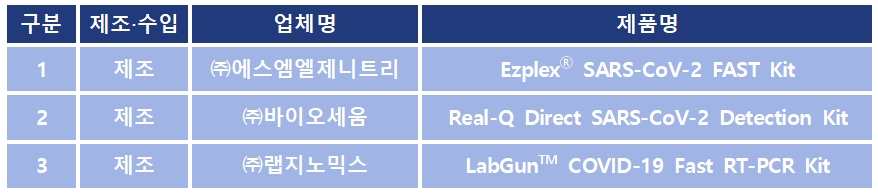
이 3개의 제품의 승인은 질병관리본부가 코로나19 응급용 선별검사 진단시약(응급환자 사용 대상으로 검체 전처리부터 결과 도출까지 1시간 이내인 제품)의 긴급사용 신청 공고(5.11)를 통해 신청 받은 13개 제품에 대해 검토한 1차 결과다.
식약처는 신청제품의 성능평가자료 등에 대한 심사와 전문가 심의 등을 통해 해당 제품의 진단의 정확성 등을 평가하여 긴급사용을 승인했으며, 이번 긴급사용승인 제품이 응급환자의 처치가 지연되는 것을 방지하는 등 신속진단 체계를 구축하는데 도움이 될 것으로 기대하고 있다.
식약처는 승인 신청된 나머지 10개 제품에 대해서는 현재 신속하게 자료를 평가해 적합한 제품에 대하여 긴급사용(허가면제) 승인할 계획 이라고 밝혔다.

