코로나19 사태가 전 세계적 팬데믹 상태에 이르자 세계 각국은 치료 치료제를 찾기 위한 다방면의 노력을 진행했다.
대표적인 연구가 미국 국립보건연구원의 주도한 렘데시비르 임상연구로, 렘데시비르를 통한 코로나19 환자의 치료 효과 실험이다.
연구결과에 따라 코로나19에 대한 렘데시비르의 효과가 밝혀졌고, 렘데시비르가 코로나19 표준치료제로 자리잡을 전망이다.
미국 국립보건연구원(NIH)가 주도한 렘데시비르(remdesivir) 임상시험 결과가 23일(미국 시각 22일 오후)에 발표됐다. 코로나19 중앙임상위원회 위원장을 맡고 있는 서울대학교 감염내과 오명돈 교수는 25일 이번 임상결과에 대한 보도자료를 배포하고 렘데시비르를 통한 코로나19 치료제 개발을 기대했다.

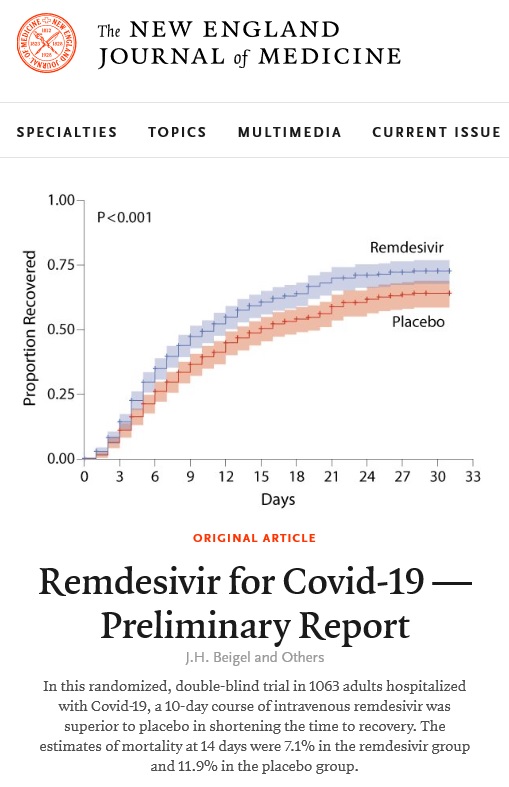
이미 5월 1일 美 FDA는 렘데시비르를 '중증환자'에게 긴급사용허가가 승인됐으며, 이번 연구 결과에 따르면, 코로나 19 환자 1063명을 대상으로 렘데시비르와 위약 투여군을 비교해 렘데시비르 치료군이 11일로 위약투여군의 15일 보다 31%나 단축된 결과를 보였다.
NIH는 중국에서 렘데시비르를 통한 코로나19 환자에 임상연구와 제조사인 길리어드社의 연구사 실시된적 있지만, 렘데시비르에 대한 정확한 효능을 평가할 수 없었다고 밝혔다.
중국에서의 연구는 273명에 대한 연구에 그쳤고, 길리어드사의 연구도 위약군을 두지 않고, 5일치료군을 10일 치료군과 비교하는 임상시험으로, 임상 결과, 렘데시비어 5일 치료군과 10일 투여군의 치료 효과나 부작용이 서로 비슷한 것으로 나왔고, 그러나 위약 대조군이 없기 때문에 그 효과가 위약보다 더 좋은지는 알 수 없다는 한계가 나타났다는 것이다.
그러나 이번 연구는 미국 뿐만 아니라 전세계 10개국, 73개 의료기관이 참여한 다국가, 다기관 임상 시험이다. 미국에서 45개 의료기관이, 유럽과 아시아에서 28개 의료기관이 참여 했으며, 아시아에서는 한국, 일본, 싱가포르가 이 임상에 참여해 총 1,063명에 대한 위약 대조 연구 디자인으로 렘데시비어의 효능을 평가가 가능했다고 설명했다.
또한 이 연구에 있어서 2차 지표였던 치사율에서도 효과가 있었다.
치료후 14일 후의 치사율이 11.9%에서 7.1%로 35%나 줄었다는 연구 결과를 보였으나, 이를 증명하기에 필요한 환자수를 확보할 수 없었다고 밝혔다. 그러나 이번 임상 대상의 환자들이 병원에 입원해 있고, 산소치료가 필요한 환자 이상이 대상이 되었기 때문에, 회복된 환자가 퇴원이 가능하거나 산소치료가 필요없는 환자가 됐기 때문에, 치료기간 단축으로 인공호흡기나 중환자실, 산소와 같은 의료 자원이 그 만큼 더 많아지는 의미있는 효과를 거두었다는 것이다.
중앙임상위원회 위원장을 맡고 있는 서울대학교 오명돈 교수는 발표자료를 통해, "렘데시비르가 코로나19의 표준치료제가 됐다"고 말했지만, "렘데시비르의 치료효과는 아직도 개선의 여지가 남아 있다"고 지적했다.
이어 그는 "이번 렘데시비르 임상은 proof of concept를 제공했고, 앞으로 이 약이 타깃으로 하는 RNA-dependent RNA polymerase를 더 잘 억제하는 제 2세대, 제 3세대 약물이 나올 것으로 기대한다. 또한 바이러스 증식 과정의 다른 부위를 타깃으로 하는 항바이러스제와 인체의 면역기능을 조절하는 약제들도 앞으로 개발될 것으로 기대한다"고 밝혔다.

