수액, 부적절한 전해질 균형 유지할 수 있어
세포 차이 있으나 동적평형상태 시 삼투농도 동일
삼투(osmosis) 또는 삼투현상은 반투막을 가운데 두고 양면의 용질 농도를 균등하게 하는 방향으로 용매의 자발적 움직임이다. 삼투압(osmotic pressure)은 반투막을 가로 지르는 용매의 순수한 이동이 없도록 적용될 필요가 있는 외부 압력으로 정의된다.
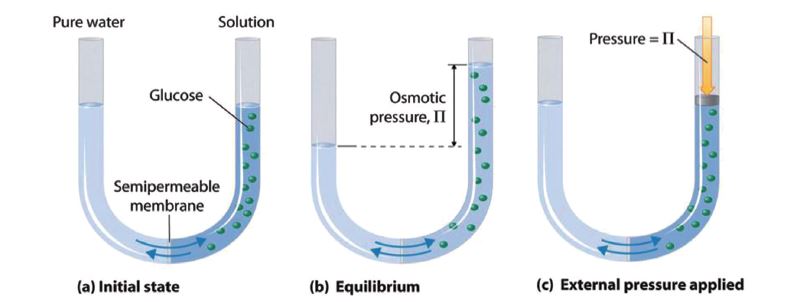
(a) 반투막을 사이에 두고 순수한 물(왼쪽)과 용액(포도당용액, 오른쪽)을 채우면 용매가 왼쪽에서 오른쪽으로 용매가 흐르게 된다.
(b) 평형상태에서 용액의 삼투압(osmotic pressure, Π)은 용매의 흐름을 동일하게 한다.
(c) 포도당 용액의 삼투압과 같은 외부 압력을 오른쪽 액체에 가하면 용매의 흐름이 바뀌며 원래 상태로 되돌린다.
반투막은 용질에게는 불투과성 막이고, 용매(물)는 투과성 막이다. 반투막을 사이에 두고 농도의 차이가 발생하면 투과할 수 있는 용매가 확산이 되고 이것이 삼투 흐름(osmotic flow)이다. 삼투압은 삼투 흐름을 멈추게 하는데 필요한 압력이다.
Jacobus Van't Hoff(네덜란드 물리화학자)는 삼투압이 각 온도증가에 대해 약 1/273 증가한다는 사실을 알고, 기체 이론을 통해 다음과 같은 공식을 만든다.

n = 용액에 포함된 용질 입자의 mole, R = 기체상수 (0.0821 L atm mol–1 K–1), T = 절대온도, V = 용액의 부피
n/V는 비해리성 용질의 몰농도(M)에 상응한다.
Van't Hoff 방정식은 실제 삼투압과 차이가 있고, 이상적인 경우에만 유효한 결과를 제공한다. 하지만 삼투압을 이용해서 용질의 분자량을 구할 수 있고, 특히 고분자화합물의 분자량 측정에 이용된다.
용액이 단독으로 있을 때는 삼투압이 발생하지 않고 이러한 경우 잠재적인 삼투압을 삼투 값(osmotic value)이라고 하고, 용액의 삼투농도(osmotic concentration)로 표시한다.
1. 삼투농도(osmotic concentration)
오스몰농도(osmolarity)로 알려진 삼투농도(osmotic concentration)는 용액(리터당)의 용질의 입자 수(osmole)로 정의되는 용질 농도의 측정값(Osm/L)이다. 이 값은 용액의 삼투압(osmotic pressure) 크기를 예측할 수 있고, 반투막을 사이에 둔 용액의 용매가 어떻게 확산 될 것인지를 결정한다.
오스몰농도는 몰농도(molarity)와 조금 다른데 비이온성 화합물인 포도당은 1몰과 1오스몰이 같으나 NaCl처럼 2개의 이온으로 해리되는 것은 2배의 용질(Na+과 Cl- 모두 삼투압에 영향을 미친다)을 갖게 되면서 NaCl 1몰은 2오스몰이 된다.
1) osmolarity vs osmolality
osmolarity는 용액의 부피당 삼투 농도의 표현(mOsm/L)이다. 임상에서 주로 사용된다.
예) 혈장 및 기타 체액 삼투농도(osmolarity)는 270~300mOsm/L이다.
osmolality는 용매의 질량당 삼투 농도의 표현(mOsm/kg)이다. 이것은 액체에 용해되어 있는 입자의 농도이다. 주로 삼투압 측정기를 사용한 임상 실험실 측정이다.
예) 소변 삼투농도(urine osmolality)는 50~1400mosm/kg으로 매우 넓은 범위이지만 평균은 약 500~800mOsm/kg이다. 하룻밤 공복 후 소변 삼투농도는 혈청 삼투농도의 3배가 되어야 한다.
혈청 삼투농도(serum osmolality)는 282~295mOsm/kg이다.
2) 삼투농도
혈장 삼투농도는 혈류에서 적절한 전해질 균형을 유지하는데 중요하다.
부적절한 균형은 탈수, 알칼리증, 산증 등이 나타날 수 있고, 수액은 삼투농도를 이용하여 정상범위내로 되돌리기 위한 처치이다. 수액은 인체 삼투농도와 비교하여 등장액(isotonic), 저장액(hypotonic), 고장액(hypertonic)으로 구분할 수 있다.
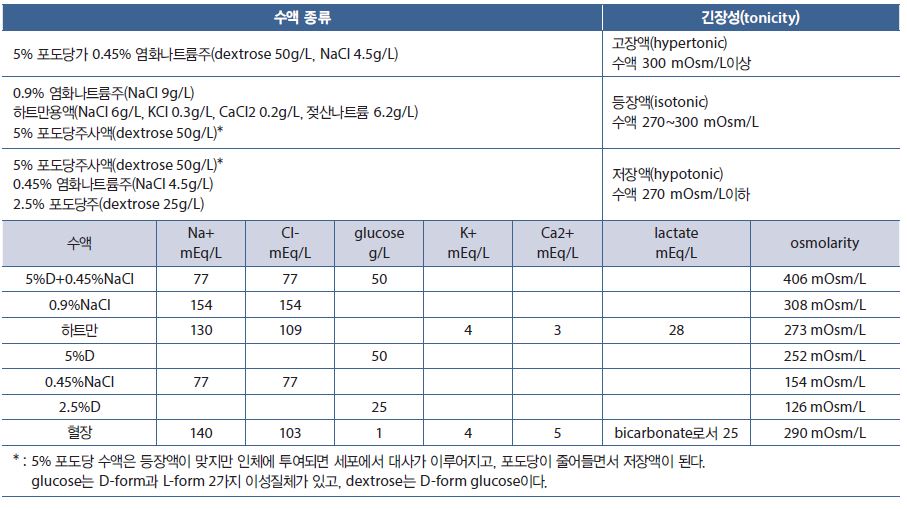
저장액은 혈액 삼투압을 낮춤으로써 물을 세포 안으로 이동시켜 세포를 부풀어 오르게 하고, 고장액은 세포 내의 물이 세포외로 이동시켜 세포를 수축시킨다. 등장액은 세포내외에 물의 순 이동이 없어서 세포에 변화가 없다.

2. 수액과 물의 변화
인체의 물은 체중의 약 60%(성별 및 지방 비율에 따라 50~70% 사이로 다양함)를 차지하고 있다.
구획에 따라 세포내액(ICF, 인체 물의 2/3)과 세포외액(ECF, 인체 물의 1/3)으로 구분이 되고, 세포외액은 세포간질액(세포외액의 3/4)과 혈장(세포외액의 1/4)으로 구분이 된다.
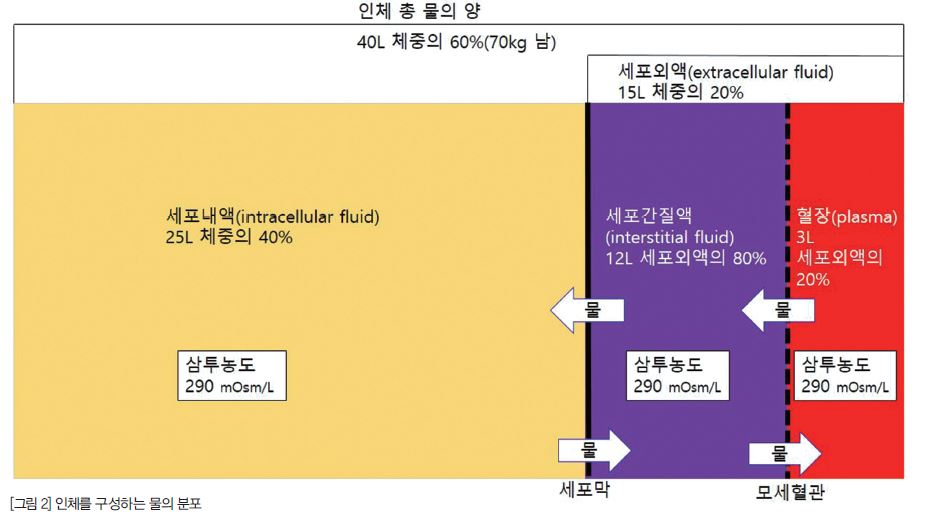
인체를 구성하는 물은 세포막과 모세혈관을 사이에 두고 조성의 차이가 있고, 세포막은 조성의 차이를 유지한다.
세포 내외의 구성차이가 존재하지만 동적평형상태(dynamic steady state)에서 삼투농도는 항상 동일하다. 물은 세포막을 가로질러 자유롭게 이동하고 이 평형상태를 유지한다.
1) 0.9% 염화나트륨 용액
나트륨(Na+)과 염소(Cl-)은 세포외액에 주로 함유되어있는 용질로서 세포외액 전체에 분포되어 있다. 0.9% 염화나트륨 용액 1,000ml 투여시 비율상 혈장에 1/4인 250ml, 세포간질액에 3/4인 750ml가 보충되어 세포외액에 1,000ml가 보충된다.
실제로 0.9% 염화나트륨 용액을 투여하면 혈장은 275ml, 세포간질액은 875ml가 증가하고 전체적으로 세포외액은 1,100ml가 증가한다. 0.9% 염화나트륨 용액은 생리식염수(isotonic saline)라고 하지만 삼투농도가 308 mOsm/L로 약간 높아 세포내에서 세포외액으로 100ml의 물이 이동한다.
0.9% 염화나트륨 용액은 구토, 설사에 의한 탈수 증상 및 출혈에 의한 혈액량 감소(15%미만)가 발생할 때 사용된다. 하지만 다량의 사용은 세포외액의 과부하, 부기, 대사성 산증(0.9% 염화나트륨 용액 pH는 5.5이다) 및 고나트륨혈증을 초래한다.
2) 포도당 용액
5% 포도당 용액은 체액 전체에 균등하게 분포된다. 혈장에 1/12인 83ml, 세포간질액에 3/12인 250ml, 세포내액에 2/3인 667ml가 증가한다. 포도당은 세포내에서 대사가 되고, 포도당의 대사로 5% 포도당 용액은 세포내로 더 이동하게 되어 혈장 내에는 75ml이하가 남게 된다.
포도당 용액은 5%, 10%, 50% 덱스트로스(dextrose)를 포함한 수액이 있는데, 시작은 고장액(hypertonic)으로 시작하지만, 포도당 대사로 인해 세포로 물이 이동하는 저장액(hypotonic)으로 작용한다.
함량이 높은 포도당 용액을 투여 받으면 혈장 삼투농도가 높아지면서 갈증을 느끼게 된다. 포도당 용액의 과도한 투여는 일시적인 티아민(thiamine) 결핍을 일으킬 수 있다.
3) 링거젖산용액(ringer’s lactate solution)
하트만 용액으로 알려져 있는 링거젖산용액은 NaCl, sodium lactate, KCl, CaCl2으로 구성되어 있고, pH 6.4, 삼투농도 273mOsm/L으로 혈장과 비슷한 구성과 같은 긴장성(isotonic)을 가지고 있다.
젖산은 간에서 대사(TCA cycle)가 이루어져 중탄산염(bicarbonate)이 되고, 대사성 산증을 막아주는 완충제(buffer) 역할을 한다.
링거젖산용액의 pH는 6.4이지만 인체에서는 알칼리화 용액이 된다. 따라서 긴 시간의 수술시 0.9% 염화나트륨 용액보다 더 안정한 pH를 유지한다.
링거젖산용액은 0.9% 염화나트륨 용액과 마찬가지로 세포외액을 보충하는 역할을 하고, 혈액량이 적거나 혈압이 낮은 사람들의 체액이나 전해질을 대체하기 위해 사용된다.


