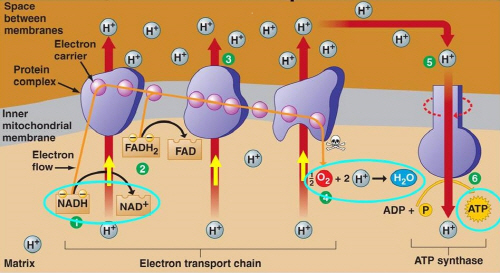
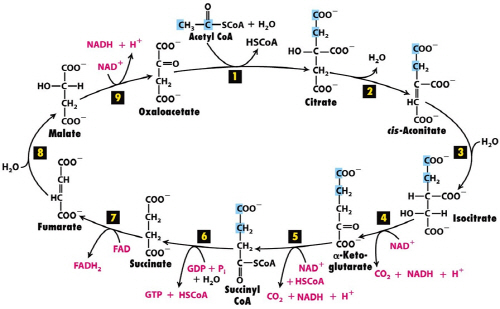
온도, 기질, 효소 농도와 함께 효소 작용 결정하는 요인
수소이온 농도에 따라 혈중 유리칼슘 달라져 인체에 영향

pH란 ‘H+’이온의 농도 지수를 말하며, 온도, 기질 및 효소의 농도와 함께 효소의 작용에 영향을 미치는 요인이다. 소화기계 효소인 pepsin은 pH 2, amylase는 pH 7, trypsin은 pH 8에서 가장 큰 활성을 가진다.
또 신체는 부위에 따라서 다른 pH를 가지고 있는데, 주로 인체의 외부(구강은 6.0~7.4, 피부는 5.5)는 약산성을 가지고 있으며 특히 위는 1.0~3.5로 강산을 가지고 있다. 인체의 내부는 동맥혈은 7.4~7.45, 정맥혈은 7.3~7.35, 모세혈관은 7.35~7.4, 간은 7.2, 뼈는 7.4, 근육은 6.9~7.2, 세포내액은 7.0으로 주로 중성을 나타낸다.


1) 물의 해리
물분자는 가역적으로 이온화하여, 수소 이온(H+)과 hydroxide ion(OH-)을 생성한다.
H2O ↔ H+ + OH-
물의 생성물로 수소이온이 나오지만 자유 양성자(수소이온)는 수용액에 존재하지 않는다. 물에서 생성된 수소이온은 즉시 hydronium ion(H3O+)으로 수화된다.
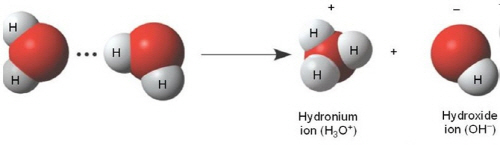
이러한 물의 반응은 물이 가지고 있는 수소결합에 기인하며, 이로 인해서 발생한 hydronium ion(H3O+)또는 수소이온(H+)을 수치화 한 것이 바로 pH가 된다. 순수한 물에서 1L속에는 H+과 OH-이 각각 10-7mol(1/1000000)만큼 있다. 각각의 농도가 작기 때문에 수소이온의 해리농도를 로그의 역수를 취해서 나타낸 값이 pH = -log10[H+] = -log1010-7 = 7 이 된다. 즉, 물의 pH는 7, H+과 OH-의 농도가 같은 중성이 된다.
2) Grotthuss mechanism
Theodor von Grotthuss(1785~1822)는 광화학(photochemistry)의 제1법칙을 제정한 독일의 화학자이다. Grotthuss mechanism이라 불리는 전기분해 이론은 첫 번째 기술로 간주한다. Grotthuss는 전기 분해 실험 및 해석 측면에서 많은 공헌을 한다. 그의 생각은 전기분해에서 전하는 입자가 직접 움직이는 것이 아니라 공유결합(그 당시에는 이온에 대한 개념이 확립이 안 되었을 때이다)의 형성과 분해에 의해서 전하가 이동한다는 개념을 만들었다. 이 이론이 바로 Grotthuss mechanism이고 이것이 후에 발전하여서 proton hopping mechanism(양성자 건너뛰기)으로 발전한다.
물의 이온화는 전기 전도도에 의해서 측정될 수 있다. 순수한 물은 H+이 음극으로 이동하고, OH-은 양극으로 이동할 때 전류를 운반한다. 전기장에서 hydronium ion(H3O+)과 hydroxide ion(OH-)의 이동은 Na+, K+, 그리고 Cl-과 같은 이온들에 비해서 상당히 빠르다. 이것을 설명하는 이론이 Grotthus mechanism, 양성자 건너뛰기가 되는 것이다.
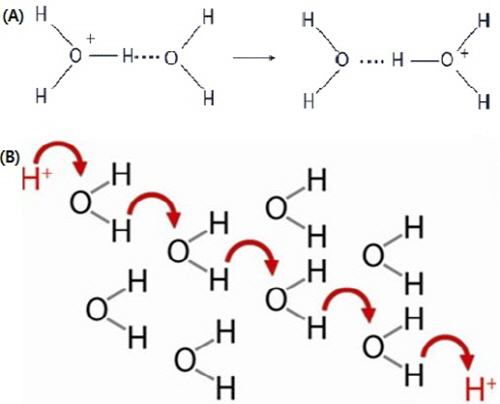
양성자 건너뛰기는 물이 가지고 있는 수소결합과 물의 해리에 있다. 물에 전류가 흐르면 hydronium ion(H3O+)과 hydroxide ion(OH-)이 이동을 하는 것이 아니라 양성자(proton)와 전자(electron)가 이동을 하여서 다른 이온보다 훨씬 빠르게 이동을 하는 것이다.
3) 산화환원 REDOX
산화(oxidation): 산소를 얻음, 수소를 잃음 또는 전자를 잃음
환원(reduction): 산소를 잃음, 수소를 얻음 또는 전자를 얻음
산화환원반응(redox): 산화와 환원은 항상 동시에 일어난다.
물질은 어떤 것으로 이루어져 있을까? 이 질문에 대한 고민은 데모크리토스의 입자설과 아리스토텔레스의 연속설로 압축이 된다. 그리고 현대과학은 물질을 분자, 원자, 전자, 원자핵(양성자, 중성자), 소립자인 쿼크와 렙톤까지 파악하고 있다.
물질에 대한 개념의 변화와 더불어 산화환원의 개념도 변화하였다. 산화환원은 물질의 변화를 이해하기 위한 개념이었다. 석탄의 연소, 철이 녹스는 것에 대한 해석을 위해서 사용된다.
C + O2 → CO2 + energy, 4Fe + 3O2 → 2Fe2O3
어떤 물질(C, Fe)이 산소와 반응을 하여서 다른 물질로 변화하는 것을 산화라고하며 산소는 환원이 된다.
이런 물질반응이 생명에서도 일어난다.
C6H12O6 + 6O2 → 6CO2 + 6H2O + energy
생명이 섭취한 유기물(포도당)은 많은 단계를 걸쳐 최종적으로 이산화탄소와 물로 물질이 변화하고 생명에 에너지를 공급한다. 이러한 과정도 생명체에서 일어나는 산화반응이고 산화반응과 동시에 환원반응이 일어난다.
|
|
NAD+ + 2H+ + 2e- ↔ NADH + H+
유기물이 산화하는 동안에 생명체의 변화는 수소와 전자의 이동만 있다. NAD/NADH, FAD/FADH, 전자전달계에서 일어나는 단백질(효소)의 산화환원이다. 이 변화를 통해서 생명은 에너지를 얻게 되지만 생명체의 변화, NAD, FAD, 전자전달계 효소 등의 변화는 없다. 하지만 수소와 전자는 끊임없이 이동(산화환원)을 하고, 만약 이 이동에 문제가 발생(TCA cycle, 전자전달계 문제)하면 에너지를 얻지 못하게 되며 생명은 심각한 문제가 발생한다.
4) pH의 의미
수소 이온 농도(pH)의 개념은 1909년 Søren Peder Lauritz Sørensen(덴마크 화학자, 1868~1939)에 의해서 처음 도입되었고, 1924년 현대에 사용하는 정의로 발전하였다. pH가 무엇의 약자인가에 대해서는 정확히 알려진 바가 없는데, 거듭제곱을 의미하는 power를 붙인 power of Hydrogen이라는 설이 있으며, 혹은 이에 대응하는 독일어 Potenz나 프랑스어 puissance에서 왔다는 주장도 있다.
아무튼 pH가 생명에서 의미하는 바는 크다. 생명에 가장 많은 물질이 물이 되고, 물은 항상 수소이온을 가지고 있으며 수소이온농도에 따라 산화환원 대사에 많은 영향을 미치고, 산화환원 대사의 영향은 효소의 활성에 영향을 미친다.
또 수소이온은 다른 양이온(Na+, K+, Ca2+ 등 양이온)보다 단백질에 더 빨리 결합(proton hopping mechanism)한다. 이런 이유로 pH가 낮아지면(수소이온농도 상승) 수소이온이 단백질에 Ca2+보다 더 많이 결합하게 되어, 유리칼슘이 증가한다. 혈중 유리칼슘의 증가는 뼈에서 칼슘의 감소로 인한 증상(구루병, 골연화증, 골감소증)이 나타나며, 심장(심장박동 증가 등)을 비롯한 인체에 많은 영향(표1 참고)을 미치게 된다. 반대로 pH가 높아지면(수소이온농도 감소) 단백질에 Ca2+이 많이 결합하게 되어, 유리칼슘이 감소하게 되고, 저칼슘혈증의 증상인 tetany(떨림증상) 및 다른 인체의 문제(표2 참고)가 나타나게 된다.
5) 수소이온은 많은 방법을 통해서 조절된다
① 산소(O2)
호흡에 의해서 들어온 산소(O2)는 전자전달계의 마지막 단계에서 생성되는 다량의 수소이온을 제거한다.
② 적혈구
유기물의 산화로 발생한 이산화탄소(CO2)는 적혈구의 carbonic anhydrase에 의해서 H2CO3(산성)로 전환이 되고, 폐와 신장으로 배설이 된다.
③ buffer system
인체의 급격한 수소이온농도의 변화를 막아준다.
이와 더불어 전자의 이동에 관여하는 antioxidant pathway도 수소이온과 관련을 가지고 있다.
<참고문헌>
서울아산병원 검색: 산증, 알칼리증
파마코세라피 임상약학백과사전, 조윤커뮤니케이션
레닌저 생화학, 월드사이언스, 데이비드 넬슨, 마이클 콕스
위키피디아 검색: Grotthuss mechanism, pH