지난 4월 식품의약품안전처가 항경련제 ‘라모트리진(lamotrigine)’의 부작용 사망자에게 ‘의약품 부작용 피해구제 제도’에 따라 첫 보상금을 지급한 가운데, 최근 일본에서도 ‘라모트리진’ 부작용으로 4건의 사망 사례가 발생한 것으로 알려져 충격을 주고 있다.
日, 6년 동안 16명 사망
일본에서 2008년 12월, 라모트리진의 판매를 시작했을 때부터 2015년 1월까지 약 6년 1개월 사이에 심각한 피부장애가 발현되어 사망에 이른 사례는 누적 16건이다. 특히 2014년 9월부터 12월까지의 약 4개월 사이에 부작용이 집중적으로 보고됐다.
이 4개월 사이에 보고된 사망증례 가운데 4건은 라모트리진과 중대한 피부장애 사이에 인과관계를 부정할 수 없는 증례이며, 모두 투여를 시작할 때부터 과용량을 사용했다.
사례별로 들여다보면 발프로산 나트리움 병용 시에 연일 투여방식으로 시작되어 증량 시기가 빠르다는 점 등에서 용법용량이 준수되지 못했던 사례가 대부분이다. 더욱이 이 4건의 사망증례는 부작용 발현 후 중독화 되기까지 투여 중지가 지시되지 않았거나 투여 중지 지시가 준수되지 못한 증례였다는 점에서 부작용을 조기 발견하고 적절한 치료 개시를 철저히 실천하는 것이 중요하다고 판단된다.
사망증례에 발현된 심각한 피부장애로는 경고란에 기재된 중독성표피괴사융해증(TEN), 피부점막안증후군뿐 아니라 약제성과민증증후군(DIHS)와의 인과관계를 부정할 수 없는 증례도 있기 때문에 약제성 과민증 증후군이 발현된다는 점도 함께 주지할 필요가 있다.
이러한 결과를 바탕으로 후생노동성은 라모트리진의 제조판매업자에게 2015년 2월 4일자로 사용상의 주의를 개정해서 경고란에 필요한 주의사항을 추기함과 동시에 의료관계자들에게 신속히 주의환기의 내용을 전달하기 위해 안전성속보를 배포하도록 지시했다.
뇌전증 남성, 투여 중지 지시 지키지 않아 사망
일본에서 발생한 사망 사례 중 하나를 들여다보면 뇌전증(epilepsy)을 앓고 있던 50대 남성이 주치의의 투여 중지 지시에도 이를 준수하지 않다가 ‘중독성 표피 괴사 융해증(TEN)’과 ‘약제성 과민증 증후군(DIHS)’으로 사망에 이르렀다.
그는 발작을 일으켜 구급 외래 진료를 이용한 이후, 발프로산 나트륨 1200mg과 함께 25mg을 8일 동안 복용했고 이후 50mg으로 증량해 38일을 복용했다.
처음 복용한 날 이후 20일 만에 현기증으로 응급실을 다시 찾았으며, 이때 발열 및 전신에 평활성구진(平滑性丘疹)이 발견됐다. 풍진 이환도 의심되는 상황이었다.
투여 개시 43일 후에는 정형외과 외래 진료 당시 피진(皮疹)이 있어 담당 의사가 피부과에 환자를 의뢰했다. 당시 라모트리진에 의한 부작용이 의심됐지만, 구강점막진이 없어 알레르기 약과 이용 스테로이드 치료로 경과를 치켜보기로 했다. 그러다 처음 라모트리진을 복용한지 46일 만에 주치의와 피부와 의사의 협의 끝에 투여를 중지했다.
피진이 회복되는 듯 했으나 18일 만에 발열과 피진 악화로 병원을 다시 찾은 50대 남성. 문진 결과 라모트리진을 중지하지 않은 것으로 밝혀졌고 곧바로 입원했지만 35일 만에 간부전으로 사망했다.
투여 24일 만에 전신 홍반 나타나, 결국 사망
조울증을 앓고 있던 60대 여성은 25일 동안 라모트리진 50mg을 복용하다 DIHS로 48일 만에 사망했다.
처음 병원을 찾았을 때, 자살 우려가 컸던 여성에게 라모트리진 50mg 처방이 이루어졌고 다음날부터 플루복사민말레인산염 150mg과 오란자핀 5mg이 추가됐다. 8일 후에는 크로미프라민염산염 75mg이 병용됐다.
투여를 시작한지 24일이 지나자 발열과 함께 전신에 홍반이 나타났다. 간부전과 신부전을 비롯해 DIHS가 발현됐고 25일 만에 라모트리진 복용을 멈췄다. 하지만 패혈증으로 전신상태가 악화되더니 투여 중지 48일 만에 다장기부전과 급성간부전, 약제유발성 과민증 증후군 및 신부전 등으로 사망했다.
6년 동안 37만명 사용된 것으로 추정
한편 일본에서 라모트리진(lamotrigine, 제품명 라미크탈 Lamictal, GSK)은 2008년 10월에 다른 전간치료약으로는 충분한 효과를 거두지 못하는 전간 환자의 부분발작(2차성 전반화 발작을 포함), 강직간대발작 및 Lennox-Gastaut 증후군에 있어서의 전반 발작에 대한 항 전간약과의 병용 요법의 효능효과로 인해 승인되었다.
그 후 2011년 7월에 쌍극성 장애에 있어서의 기분(氣分) 에피소드의 재발재연 억제의 효능으로 인해서 그리고 2014년 8월에는 전간 환자의 부분 발작(2차성 전반화 발작을 포함) 및 강직간대발작에 대한 단제 요법의 효능효과로 인해서 각각 승인되었다.
제조판매업자 측에 따르면 판매개시(2008년 12월 12일)로부터 2014년 12월 31일까지 약 37만6000명에게 사용된 것으로 추정된다.
식약처, 악몽과 무균수막염 등 이상반응 추가 움직임
국내에서도 라모트리진의 부작용을 두고 식약처의 움직임이 활발하다.
우선 지난 4월에는 식약처 의약품부작용심의워위원회에서 라모트리진을 복용한 이후 사망한 사례에 대해 6,997만원의 보상을 지급하기로 결정했다. 이 환자는 라모트리진 복용 후 피부 점막이 손상되는 ‘독성표피괴사융해(TEN)’ 부작용이 인정되어 올해 처음 도입된 ‘의약품 부작용 피해구제 제도’의 첫 수혜자가 됐다.
이밖에도 최근에는 드물게 '악몽' 등의 이상반응이 발현된 것이 인정되고 있는 추세이다.
식약처는 지난 5월 ‘라모트리진 단일경구제'에 대해 안전성·유효성 심사 등을 근로 이와 같은 내용의 사용상의 주의사항 통일조정안을 제시, 지난 6월3일까지 의견조회를 실시했다고 밝혔다. 통일조정안에는 또 드물게 '무균수막염' 이상반응이 새롭게 추가됐다.
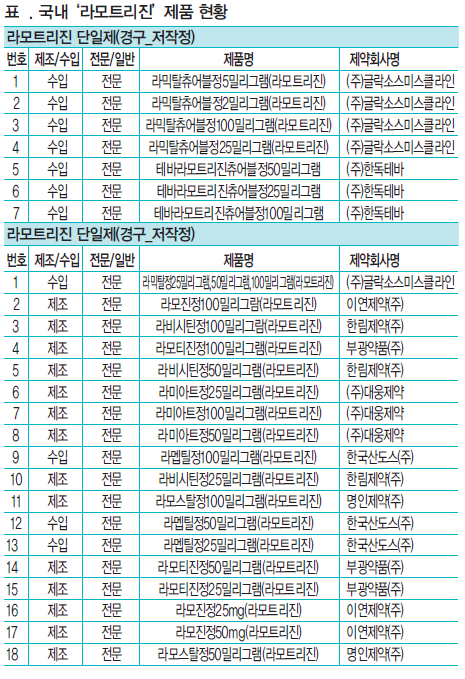
대상품목은 라모트라진 단일제(경구 저작정)는 글락소스미스클라인의 라막탈츄어블정5mg 등 4품목을 대조약으로 해 한독테바의 테바라모트리진츄어블정50mg 등 3품목, 라모트리진 단일제(경구 정제)는 글락소스미스클라인의 '라믹탈정25mg' 등 3품목을 대조약으로 대웅제약 '라미아트정25mg' 등 17품목이 통일조정에 포함됐다.

