항악성 종양제인 ‘자이티가(Zytiga, 성분명 아비라테론아세테이트)’가 일본에서 부작용으로 사망환자를 배출함에 따라 일본 후생노동성이 사용상의 주의를 개정한 것을 나타났다.
일본 후생노동성은 올해 2월 2일자로 “2014년 9월 판매를 시작한 이래 ‘자이티가’와 인과관계를 부정할 수 없는 중독(重篤)한 저칼륨혈증의 증례가 복수로 보고되었고 이 중 사망사례가 포함된 점을 감안해 제조판매업자에게 사용상의 주의를 개정하도록 지시했다”고 밝혔다.
‘자이티가’는 2014년 7월 일본에서 얀센파마가 승인을 받아 9월부터 아스트라제네카와 공동으로 판촉하고 있다. ‘기타의 종양용약’으로 분류되어 있으며 ‘거세 저항성 전립선암’의 치료로 허가를 받았다.
안드로겐 합성효소인 17a-hydroxylase/C17, 20-lyase(CYP 17)의 활성을 억제함으로써 종양 내의 테스토스테론과 디히드로스테론 함량을 저하시켜 종양의 증식을 억제하는 악성 종양 치료제이다.
이번에 문제가 된 ‘저칼륨혈증’에 대해서는 승인 당시부터 첨부문성 등을 통해 일정한 주의 환기가 이루어져온 것으로 나타났다.
‘자이티가’ 투여로 인한 저칼륨혈증의 발현은 CYP 17 억제작용에 수반되는 광질(鑛質)코티코이드 과잉상태에 기인한 것으로 생각되고 있다. 승인 심사 당시 제출된 국내외 임상시험에서 있어서 저용량의 당질(糖質)코티코이드(국내시험에서는 프레드니솔론)를 병용함으로써 저칼륨혈증의 발현을 경감됐다. 저칼륨혈증에 의한 투여 중지 예도 나타나지 않았음을 감안해 승인 용법·용량으로서의 프레드니솔론과의 병용이 규정됐다.
또한 저칼륨혈증에 대해서는 프레드니솔론 병용 하의 임상시험에 있어서의 발현 현황 등을 바탕으로 첨부문서 ‘중요한 기본적 주의’의 항목 등에서 주의환기가 이루어져왔다.
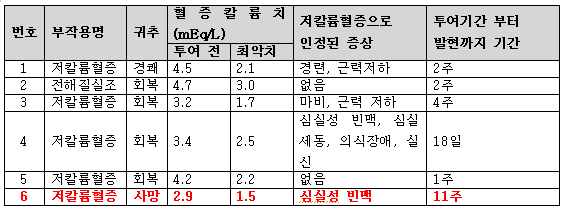
하지만 일본에서 ‘자이티가’의 본격적인 판매가 시작된 2014년 9월 2일 이래, 그해 12월 31일까지 약 4000명의 환자에게 투여되었고 2015년 1월 9일까지 사망 1례를 포함한 6례가 중요한 저칼륨혈증의 증례로 보고되고 있다.
이에 따라 일본 후생노동성은 2015년 2월 2일자로 얀센에게 ‘자이티가’의 사용상의 주의를 개정하도록 지시했으며, 얀센 측은 독립행정법인 ‘의약품의료기기 종합기구(PMDA)'의 지도하에 의료관계자용 자재(적정사용에 관한 통지)를 작성해 2월 2일부터 의료기관에세 정보제공을 시작했다.
일본에서 ‘자이티가’의 판매 이후 2015년 1월 9일까지 저칼륨혈증으로 인한 부정맥으로보고된 증례는 총 7예로 이 중 ‘자이티가’와 인과관계를 부정할 수 없는 증례는 4예이다. 특히 한 케이스에서는 사망 사례도 보고되고 있다.
사망 사례를 살펴보면 ‘자이티가’ 복용 뒤 11주 이후 저칼륨혈증으로 인한 심실성빈맥이 발현되었으며, 혈증칼륨치는 복용 전에 2.9mEq/L에서 복용 후 1.5mEq/L까지 떨어졌다.
일본 내에서 시판이 시작된 이후 보고된 부작용 사례는 아래와 같다.
국내에서 ‘자이티가’는 2012년 ‘항악성종양제’로 승인 받아 ‘자이티가정 250mg'을 한국얀센이 판매하고 있다.
‘프레드니솔론과 병용하여, 이전에 도세탁셀을 포함한 화학요법을 받았던 전이성 거세 저항성 전립선암 환자의 치료’로 적응증을 받았다.
국내 시판 후 조사에서 보고된 이상반응으로는 알러지성 폐포염이 0.01% 이상 0.1% 미만으로 드물게 보고되었으며, 갈락토오스 불내성(galactose intolerance), Lapp 유당분해효소결핍증(Lapp lactose deficiency) 또는 포도당-갈락토오스 흡수장애(glucose-galactose malabsorption)등의 유전적인 문제가 있는 환자와 중등도 또는 중증 간장애 환자에게 사용이 금지되어 있다.

